สารในชีวิตประจำวันเช่นแก๊สออกซิเจนและแก๊สคาร์บอนไดออกไซด์ที่เกี่ยวข้องกับกระบวนการหายใจของสิ่งมีชีวิตน้ำเป็นของเหลวที่ใช้ในการอุปโภคและบริโภคเกลือแกงเป็นของแข็งที่ใช้ในการประกอบอาหารสารเหล่านี้ส่วนใหญ่ไม่อยู่ในรูปอะตอมเดี่ยวแต่ประกอบด้วยหลายอะตอมซึ่งอาจเป็นอะตอมชนิดเดียวกันหรือต่างชนิดกันการยึดเหนี่ยวกันของอะตอมหรือไอออนในสารเรียกว่าพันธะเคมี
3.1 ลักษณะแบบจุดของลิวอิสและกฎออกเตต
จากการศึกษาเรื่องอะตอมและสมบัติของธาตุทำให้ทราบว่าเวเลนซ์อิเล็กตรอนเป็นอิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุดหรือชั้นนอกสุดของอะตอมธาตุคาร์บอนมีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อยเป็น 1s^2 2s^2 2p^2 ดังนั้น คาร์บอนมีเวเลนซ์อิเล็กตรอนเท่ากับ 4 ทั้งนี้การเกิดพันธะเคมีเกี่ยวข้องกับเวเลนซ์อิเล็กตรอนของอะตอมที่ร่วมสร้างพันธะกันเวเลนซ์อิเล็กตรอนของธาตุอาจแสดงด้วยจุดสัญลักษณ์ที่แสดงธาตุและเวเลนซ์อิเล็กตรอนของธาตุเรียกว่า สัญลักษณ์แบบจุดของลิวอิสซึ่งเสนอโดย กิลเบิร์ต นิวตัน ลิวอิส สัญลักษณ์แบบจุดของลิวอิสใช้จุดแสดงจำนวนเวเลนซ์อิเล็กตรอนรอบสัญลักษณ์ของธาตุดังรูป
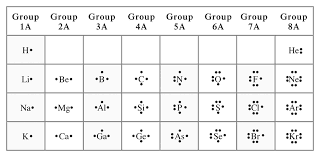
ธาตุต่างๆส่วนใหญ่ไม่เสถียรในรูปอะตอมเดี่ยวยกเว้นเพื่อนในหมู่ 18 หรือเรียกว่าแก๊สมีสกุลที่ผมอยู่ในรูปอะตอมเดี่ยวซึ่งมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากับ 8 ยกเว้นฮีเลียมซึ่งมี 2 เวเลนซ์อิเล็กตรอนนอกจากนี้นักเคมี ยังพบว่าอะตอมของธาตุอื่นๆมีแนวโน้มที่จะรวมตัวกัน เพื่อที่จะทำให้แต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเท่ากับ 8 จึงมีการสรุปเป็นหลักการที่เกี่ยวกับกฎออกเตต ศาลที่ไม่อยู่ในรูปอะตอมเดี่ยวมีพันธะเคมีระหว่างอะตอมหรือไอออนโดยที่อะตอมของธาตุจะมีการให้อิเล็กตรอนรับอิเล็กตรอนหรือใช้อิเล็กตรอนร่วมกันทำให้เกิดพันธะเคมีสารประเภทได้แก่พันธะไอออนิกพันธะโคเวเลนต์และพันธะโลหะ


ไม่มีความคิดเห็น:
แสดงความคิดเห็น